Vinicio Barrientos Carles
Guatemalteco de corazón, científico de profesión, humanista de vocación, navegante multirrumbos… viajero del espacio interior. Apasionado por los problemas de la educación y los retos que la juventud del siglo XXI deberá confrontar. Defensor inalienable de la paz y del desarrollo de los Pueblos. Amante de la Matemática.
La mayor parte de los logros científicos son, hasta cierto punto, esfuerzo de grupo.
Willard Frank Libby
Willard Frank Libby (1908 – 1980) fue un químico y profesor universitario estadounidense galar_donado con el Premio Nobel de Química en 1960, por el desarrollo del método basado en el isótopo del carbono 14 para el análisis temporal de los restos orgánicos. Libby participó activamente en el desarrollo de un procedimiento de separación de los isótopos del uranio, en la fase inicial del conocido Proyecto Manhattan, para la fabricación de la bomba atómica, durante la Segunda Guerra Mundial.
Este método de datación, basado en el isótopo 14C radioactivo, se dan una conjunción de procesos, siendo el ultimo, al final de la cadena, el que corresponde al titular del artículo, relacionado con la vida media de este isótopo, mediante la cual es posible estimar la antigüedad de un fósil o un material que contenga restos orgánicos, como estamos familiarizados a comprender.
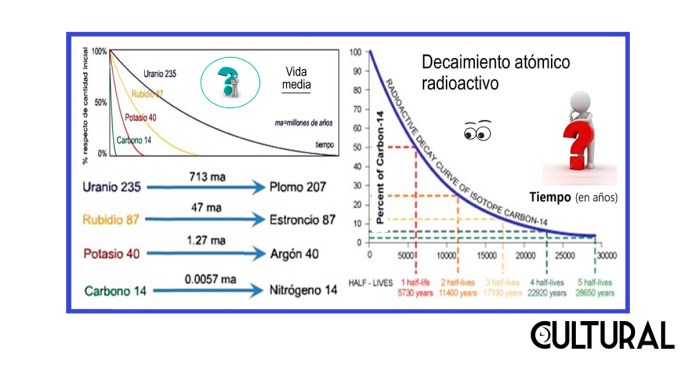
El decaimiento radioactivo refiere al fenómeno de la radiactividad, también conocido como radiación nuclear o desintegración nuclear, puesto que se trata del proceso natural mediante el cual un núcleo atómico inestable pierde energía mediante la emisión de radiación, como una partícula alfa, como una partícula beta con neutrino, o solo un neutrino, en el caso de la captura electrónica, o un rayo gamma o electrón, en el caso de conversión interna.
Debido a esta desintegración nuclear, la masa de un determinado material radioactivo disminuirá en el tiempo, a una tasa de cambio que será proporcional a la cantidad de material existente. Esta particularidad, define una ecuación diferencial que permite la determinación de una curva que responde a un decrecimiento exponencial, el cual, a su vez, permite el cálculo del tiempo que se lleva en esta evolución. Los materiales radioactivos se convierten, de esta forma, en relojes naturales mediante los que es posible observar la historia de los materiales o las muestras. Véanse las curvas en la imagen precedente. Sobre la radiación, en la Wikipedia se lee:
Un material que contiene estos núcleos inestables se considera radiactivo. Ciertos estados nucleares de vida corta altamente excitados pueden decaer a través de emisión de neutrones, o más raramente, emisión de protones. La desintegración radioactiva es un proceso estocástico (es decir, aleatorio) a nivel de átomos individuales. Según la teoría cuántica, es imposible predecir cuándo se desintegrará un átomo en particular, independientemente de cuánto tiempo haya existido el átomo. Sin embargo, para una colección de átomos, la tasa de decaimiento esperado de la colección se caracteriza en términos de su constante de decaimientos, o vidas medias medidas.
Así, en sus estudios, Libby pasó a especializarse en el estudio de la radiactividad y sus efectos en los tejidos vivos, introduciendo, en 1949, un cómputo cronológico basado en la radioactividad del isótopo 14 del carbono, contenido en los fósiles y los restos orgánicos, procedimiento mediante el cual era factible establecer la edad de dichas muestras, metodología que sería posteriormente sistematizada y pronto denominada sistema para la datación por radiocarbono, fundamentada justamente en la cantidad presente de trazas del carbono 14 remanente en los fósiles. Si se conoce la cantidad inicial en una cierta muestra de material, el cálculo de la cantidad persistente informa sobre la antigüedad de la muestra:
Esta es la base de la datación radiométrica. Las vidas medias de los átomos radioactivos no tienen un límite superior conocido, que abarca un rango de tiempo de más de 55 órdenes de magnitud, desde casi instantáneo hasta mucho más largo que la edad del universo. Bien aplicado, se trata de un método altamente confiable.
Pues bien, como hemos mencionado, en el funcionamiento del citado método de datación influyen e intervienen varios procesos, todos ellos interesantes de por sí. En primer lugar, la atmósfera terrestre es abundante en nitrógeno (cerca del 78 %), y en la misma se suceden varias reacciones nucleares cuando esta es bombardeada por las radiaciones ionizantes provenientes del espacio exterior, fundamentalmente a través de las reacciones que se suceden en el sol.
En particular, de una de estas reacciones se genera el denominado carbono 14, isótopo del elemento químico del carbono sobre el que se basa el método de datación para muestras orgánicas. Resulta que el isótopo 14C radioactivo se desintegra a una razón constante, conocida, de manera que los arqueopaleontólogos pueden determinar la edad de un fósil, midiendo la cantidad remanente del isótopo. Véase el diagrama siguiente con el esquema del proceso completo.
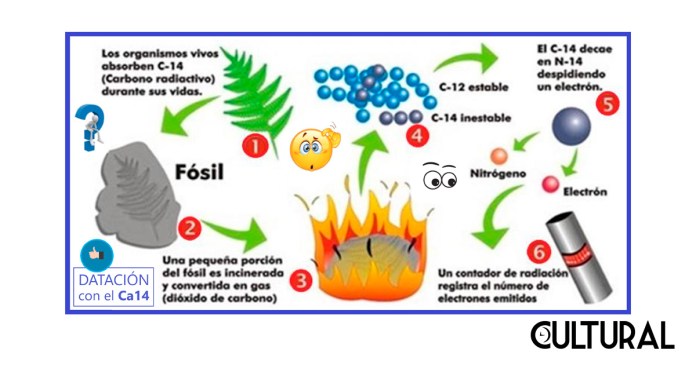
Una primera pregunta, fundamental, es de dónde los organismos biológicos obtienen el isótopo 14C radioactivo que siempre tienen. Resulta que, después de que los rayos cósmicos del Sol colisionan con los átomos de 14N de la atmósfera, convirtiéndolo en 14C radioactivo, este isótopo se combinará con el oxígeno de la atmósfera para formar CO2 radioactivo. De esta forma que los seres vivos, que se encuentran en equilibrio e interacción permanente con la atmósfera del planeta, absorberán el CO2 radio_activo, vía la fotosíntesis o por la ingesta biótica en los océanos y en los distintos ecosistemas.
En consecuencia, el isótopo radioactivo del 14C entra de lleno en la cadena alimenticia y en el ciclo vital del carbono, presente en los distintos organismos del planeta, que incorporan en su metabolismo un procesamiento especial del isótopo radioactivo de nuestro interés. Es posible verificar que todos los seres vivos contienen una proporción entre los isótopos del carbono, 14C/12C, la cual permanece constante en cada organismo, de acuerdo a ciertos procesos biológicos y homeostáticos, siendo esta proporción cercana a uno por cada millardo de átomos de carbono presentes en todo el planeta.
Así, para mantener la proporción de 14C a 12C es requerido que el complejo orgánico de carbono esté vivo, de donde puede implicarse que, al morir este organismo, se detendrá este proceso equilibrante. Esto significa que cuando el organismo ya no está vivo, se iniciará un cambio en la proporción 14C/12C, porque la homeostasis ya no se presenta. Entonces, tras la muerte, cesará la incorporación de átomos de 14C, decayendo estos de forma natural, dada su naturaleza radioactiva, es decir, transformándose en 14N sin ser estos reemplazados por nuevos átomos de 14C.
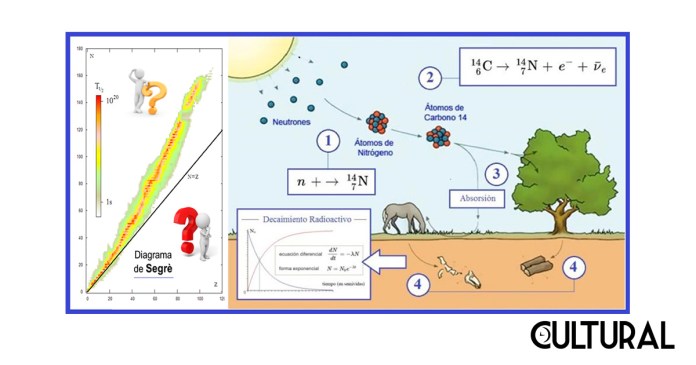
Por lo anterior, de manera fabulosa y sorprendente, se puede utilizar el conteo del isótopo 14C como predictivo del tiempo transcurrido desde la muerte del organismo, siendo este el fundamento para datar un fósil, esto es, para establecer su edad, pues el cambio observado en la proporción 14C/12C, del que originalmente poseía el organismo cuando estaba vivo, determina unívocamente el tiempo que llevan estos compuestos de carbono sin estar organizados biológicamente. En la imagen primera se observa que la vida media del 14C es pequeña, comparado con el potasio (K) o el uranio (U), que ahí se incluyen, lo que también representa un importante parámetro para medir dataciones recientes, en términos cósmicos.
En complemento, el diagrama de la imagen segunda proporciona un buen resumen de la secuencia principal de procesos sobre los que está basado el método de datación por radiocarbono, enfatizando los dos puntos principales, que son, ¿de dónde procede el 14C?, y, sobre todo, ¿cómo se utiliza para determinar la antigüedad de un compuesto orgánico, que en algún momento fue un ser vivo?
En estos dos puntos existen hechos científicos importantes, que vale la pena resaltar:
- que existen reacciones nucleares que se presentan de forma natural y que implican una transformación continua de las proporciones entre las cantidades de átomos de los distintos elementos conocidos
- que ciertos átomos decaen radioactivamente mucho más que otros y que este decaimiento proporciona una relación directa entre las cantidades existentes de los elementos y el tiempo transcurrido de un determinado fenómeno, convirtiéndose de manera bastante segura en relojes incorporados en la materia.
Como consecuencia de que este decaimiento radioactivo puede ser modelado matemáticamente, se tiene que, resolviendo ciertas ecuaciones diferenciales, es posible concluir que tales fenómenos son de tipo exponencial, es decir que siguen progresiones geométricas decrecientes, muy similares a los modelos que siguen las poblaciones biológicas bajo determinadas condiciones de bonanza al inicio de un crecimiento acotado mucho más general. Obsérvese la imagen siguiente.
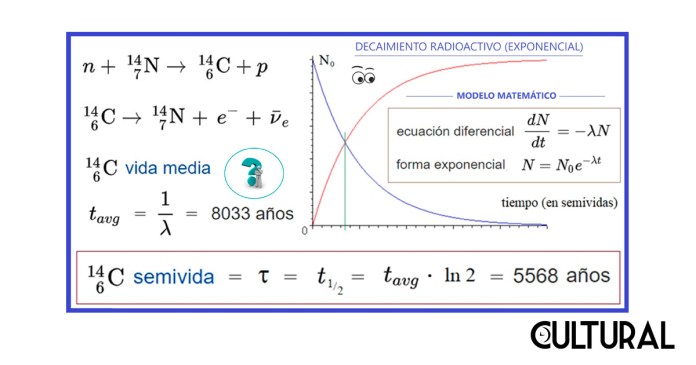
Uno puede preguntarse si únicamente el carbono permite este tipo de mediciones indirectas, o más específicamente, si se trata solo del isótopo 14C. A decir verdad, estos son fenómenos generales, que aplican en otros contextos y con otros elementos químicos, y será en lo que sigue que estaremos ampliando otros detalles sobre estos interesantes procesos que muestran la importancia de los modelos cuantitativos como herramientas para el conocimiento profundo de los fenómenos, pudiendo los mismos ser la base y el fundamento científico para desarrollar analíticas predictivas que realizan pronósticos o mediciones indirectas, con una precisión aceptable y suficientemente buena.
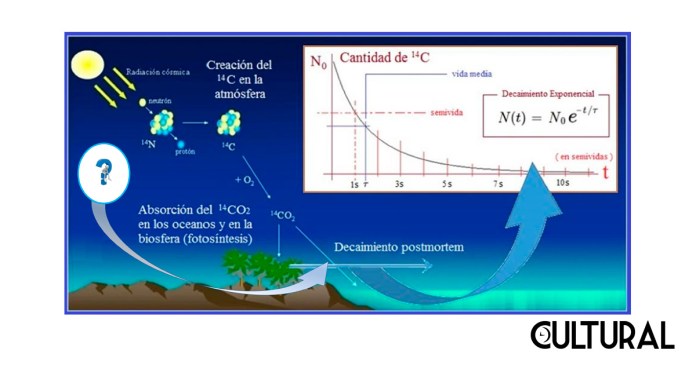
En la imagen primera se muestra la curva predictiva que resulta del uso del isótopo del 14C, así como un esquema del comportamiento de otros procesos radioactivos basados en diferentes elementos químicos predictores. En el orden de magnitud de la semivida, sigue al carbono (14C) el decaimiento del potasio al argón, (40K/40Ar), el cual tiene relativa importancia en campos académicos como la Geología, en la segunda parte del artículo estaremos concluyendo por qué razón. Según sea la vida media de un determinado elemento, así las aplicaciones de pueden surgir de su correspondiente medición. Para el caso del decaimiento del 14C, la imagen siguiente ilustra la lógica de su uso y aplicación.
Recapitulando hasta aquí, hemos presentado, de manera sintética, la secuencia de procesos sobre los cuales se fundamenta el método cronológico para la datación por radiocarbono, desarrollado por el químico estadounidense Willard Libby, citado en nuestro epígrafe, quien fue justamente galardonado en 1960 con el Premio Nobel de Química. En este sentido, muchas veces, en vías a sintetizar los distintos temas de tipo científico, se pasan por alto detalles que resultan cruciales en la comprensión de los fenómenos. En particular, la cita refiere al trabajo en grupo, cada día más indispensable para el logro de nuevos resultados, lo que se ve reflejado en los galardones, tipo Premio Nobel, compartidos.
También es cierto que, en los conversatorios de ciencias, a diferencia de los coloquiales, el escepticismo y la duda sistemática son elementos que siempre serán bienvenidos y, en términos generales, cualquier tema puede ser perfectamente abordado y posteriormente comprendido si se explica lo suficiente y se cuenta con una actitud receptiva pertinente, y se dispone del tiempo necesario para la aprehensión. Por ello, en esta oportunidad conviene dar continuidad a los fundamentos de los procesos involucrados, mencionados en lo precedente, enfatizando ciertos aspectos que resultan interesantes, o que pueden aportar valor a la temática y a la metodología utilizada. En el esquema que sigue se muestra la secuencia de los cuatro procesos componentes básicos, así como los tipos de radiación.
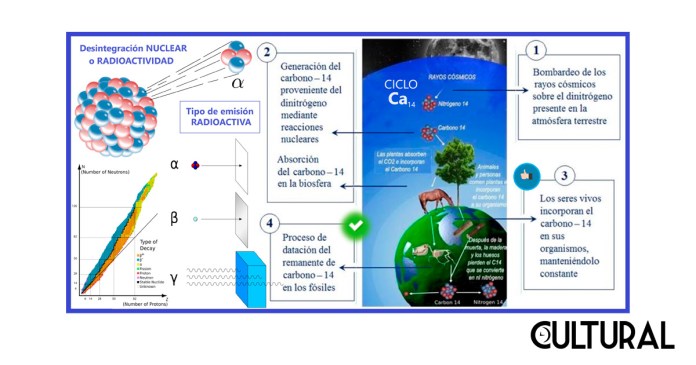
Para empezar, es importante comprender qué es exactamente el carbono 14, simbolizado 146C. Recordemos que los átomos se componen, principalmente, de un núcleo y de una «nube» de electrones que gira alrededor de este. En el núcleo se encuentran los protones, que dan las características químicas al átomo, y los neutrones, sin carga, que contribuyen a dar estabilidad al núcleo, y que, junto con los protones, determinan la masa atómica del mismo, en vista de que estas dos partículas poseen la mayoría de la masa de un átomo.
Lo que hace que un átomo corresponda a un cierto elemento químico es el número atómico, es decir, el número de protones que contiene el núcleo. Por ejemplo, el elemento carbono tiene número atómico 6, lo que significa que cualquier átomo que sea del elemento carbono, símbolo C, tendrá indefectiblemente seis protones en su núcleo. El elemento queda determinado por el número atómico, y el número atómico define de qué elemento en la naturaleza se trata. El símbolo conven_cional y su representación, Z, proviene de la palabra alemana Atomzahl, esto es, número atómico. El símbolo N, número neutrónico, es el número de neutrones que un átomo posee.
Por otro lado, es importante recalcar que el carbono constituye el elemento esencial de toda la química de la vida, y por ello se encuentra presente en gran abundancia en todos los organismos vivos del planeta, así como en el suelo, en los océanos y en la atmósfera que circunda la biosfera del planeta. Otro elemento que también se halla en abundancia, tanto en el suelo como en la atmósfera, es el nitrógeno, 147N, en donde los numeritos indican el número de protones de cada átomo y el número total de protones y neutrones, que representa un aproximado de la masa total del átomo.
Así, en el caso previo, el 7 indica el número atómico, mientras el número neutrónico puede obtenerse por diferencia. La notación 147N indica que este átomo de nitrógeno tiene 7 protones, y el número de neutrones se obtiene de 14 – 7 = 7. Por otro lado, en este momento hemos clarificado, indirectamente, el concepto de isótopo, en vista de que, como se mencionó, aunque el número de protones caracteriza a un elemento químico, siendo fijo, el número de neutrones es variable para los átomos de un mismo elemento.
Por ejemplo, en la naturaleza hay tres isótopos naturales del carbono: dos de ellos, el carbono 12 y el carbono 13, son estables y un tercero, el carbono 14, de nuestro interés, es inestable, es decir radiactivo. En cuanto a las proporciones de estos tres isótopos del carbono, de seis protones todos, se observa que el 98.89 % es carbono 12 (126C, el isótopo más abundante, conteniendo seis neutrones,), un 1.11 % es carbono 13 (136C, el otro isótopo estable, pero que contiene siete neutrones) y tan solo un 0.0000000001 % = 10-12 es carbono 14 (146C, el isótopo inestable, que contiene ocho neutrones y que suele sufrir desintegración radioactiva en una determinada propor_ción).
Como se puede concluir de estas frecuencias de observación en la naturaleza, la proporción de carbono 14 es verdaderamente ínfima, pero, aun así, resulta perfectamente medible con la tecnología actual. En el proceso primero, el bombardeo rayos cósmicos provenientes del sol producen neutrones, los cuales pasan a reaccionar con los núcleos de los átomos de dinitrógeno presentes en la atmósfera, haciéndole perder uno de los protones en su núcleo. Así el 147N pasa a ser 146C, con seis protones y… ¡ocho neutrones!
Esta es la forma en que se origina un nuevo átomo de carbono 14, especialmente a determinadas altitudes, donde los átomos de nitrógeno se encuentran mayormente expuestos a las radiaciones de partículas que constantemente bombardean nuestro planeta, procedentes del espacio exterior. Así, estos nuevos átomos de carbono 14 se distribuyen por la atmósfera de forma regular, combinándose rápidamente con el oxígeno existente, para formar dióxido de carbono radioactivo (146CO2), el cual se introduce en el ciclo natural de la biosfera terrestre.
Finalmente, este dióxido de carbono radioactivo termina siendo procesado por las plantas a través de la fotosíntesis y es absorbido por estas. Luego, la cadena trófica hace que todos los animales (que de una u otra forma se alimentan de plantas o de seres que comen plantas) terminen absorbiendo en su organismo el mismo porcentaje de carbono 14 radioactivo presente en la atmósfera, esto es, un porcentaje fijo de 146C.
Comentamos anteriormente que resulta clave comprender que mientras la planta o el animal siguen con vida, esta absorción se seguirá produciendo de forma constante, por un maravilloso sistema homeostático que conserva constante la proporción de 146C radioactivo presente en el organismo. Esta proporción constante solo iniciará su disminución cuando este ser vivo fallezca, concluyendo así el intercambio natural con el resto de la biosfera, lo cual sucede después de morir, generalmente al quedar enterrado o aislado de su entorno natural.
Básicamente, cuando el organismo ha muerto, el carbono 14, este escaso isótopo radiactivo del carbono, va a iniciar su decaimiento radioactivo natural y la cantidad presente decaerá de forma exponencial. Este es el último de los procesos orgánicos y bioquímicos que se darán, estableciendo de manera matemática una relación que permite predecir el tiempo que llevan los restos fósiles después de que el organismo ha muerto, a partir de la cantidad remanente del isótopo radioactivo del 146C. En suma, cuanto más tiempo permanezca un resto orgánico enterrado, como fósil, menor será la cantidad de carbono 14 remanente que contenga.
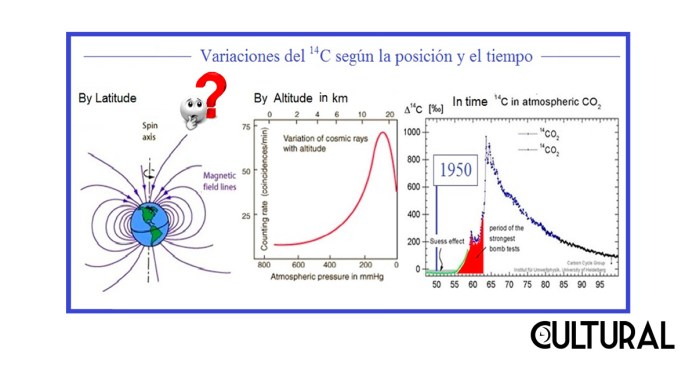
Existen varios detalles en los que se debe ser cuidadoso al aplicar el método de datación. Por ejemplo, la cantidad de 146C no es constante en el planeta, pues varía según la latitud del lugar, debido a las variaciones del campo magnético terrestre, por rotación o por otras variables difíciles de controlar, y también varía por la altitud en donde se encuentra la muestra. También se asume que la cantidad de 146C en la biosfera terrestre ha variado a lo largo del tiempo, por lo que no puede usarse una fecha cualquiera en la línea geológica.
En particular, debido a la serie de experimentos nucleares realizados en la reciente época de la posguerra, por detonación de varios tipos de artefactos de reacción nuclear, se estableció como referencia temporal para la datación, las cantidades medidas de tal isótopo del elemento en el año de 1950, año durante el cual el mismo Libby participó en la determinación de las cantidades basales sobre las cuales realizar los cálculos del decaimiento radioactivo. Por ello, los resultados de datación obtenidos por este método del carbono 14 se suelen dar en años antes del presente (years BP, en inglés), en donde el presente indica el año de 1950.
Nuevamente, un aspecto que vale recalcar es que este sistema de medición indirecta puede funcionar con otros elementos, de una forma perfectamente similar al descrito, con la gran diferencia que el isótopo 14C tiene una vida media muy corta, específicamente de 8 033 años. De esto es posible deducir que la semivida, o período de semidesintegración, es de apenas 5 568 años, lo que significa que una cierta cantidad inicial de 146C disminuirá a la mitad exactamente en 5 568 años. Podrá calcularse que, en cada semivida, la cantidad presente de 146C decae a la mitad.
Para presentar un ejemplo sencillo, si una cantidad inicial de 160 baja a 10 (su 16ava parte) podrá deducirse que cuatro semividas han transcurrido desde el deceso del organismo. La curva predictiva que resulta del uso del isótopo del 14C utiliza entonces una semivida de 5 568 años. También mencionamos lo útil que resulta que la vida media del isótopo 14C sea tan baja, comparado con los otros elementos radioactivos, porque ello permite discriminar hechos relativamente recientes, en el horizonte de los últimos cien mil años, uno que es particularmente importante para la paleoantropología y la historia escrita, por citar dos casos.
En este sentido, otros elementos son utilizados como marcadores eficientes para dataciones mayores, de tipo geológico, por ejemplo. Es el caso del decaimiento del potasio al argón, (40K/40Ar), el cual utiliza una semivida de 1.27 millones de años, por lo que una reducción a una 16ava parte del potasio al argón implicaría una antigüedad de 5 millones de años, lo cual sería prácticamente imposible de determinar con el método de datación del 146C. En la imagen primera se muestran otros decaimientos radioactivos utilizados en Geología, tales como el del rubidio 87 al estroncio 87, o el mismo uranio 235 que decae en el plomo 207. El método en cualquiera de estos casos es similar al correspondiente al del isótopo 146C.
Fuente de imágenes:
[ 1 ] Imagen editada por Vinicio Barrientos Carles :: Redsearch + EHU
[ 2 + 6 ] Imagen editada por Vinicio Barrientos Carles :: Física y Química 2° Bachillerato + https://es.wikipedia.org/wiki/Radiactividad
[ 3 + 7 ] Imágenes elaboradas por Vinicio Barrientos Carles
[ 4 ] Imagen editada por Vinicio Barrientos Carles :: Antonio Luis Pozuelo
[ 5 ] Imagen editada por Vinicio Barrientos Carles :: https://es.wikipedia.org/wiki/Radiactividad + Ciencia es








