Vinicio Barrientos Carles
Guatemalteco de corazón, científico de profesión, humanista de vocación, navegante multirrumbos… viajero del espacio interior. Apasionado por los problemas de la educación y los retos que la juventud del siglo XXI deberá confrontar. Defensor inalienable de la paz y del desarrollo de los Pueblos. Amante de la Matemática.
Si hay magia en este planeta, está contenida en el agua.
George Bernard Shaw
El agua es la substancia líquida más abundante en el planeta, siendo también bastante común en nuestro sistema solar, donde se encuentra, por lo general, en forma de vapor o de hielo. Aunque el término refiere al compuesto químico, en cualquier estado físico, suele interpretarse, en la mayoría de contextos, al agua en su específico estado líquido, que es la forma en la que se le encuentra por lo general. En complemento, hablamos de hielo para referirnos al agua en su forma sólida y de vapor para especificar su forma gaseosa. Por otro lado, la superficie terrestre, la corteza, está cubierta por agua, en un 71 %.
Por esta condición última, y por cómo se observa el planeta desde el exterior, alguien ha comentado que este debería llamarse «Agua» y no «Tierra». El término castellano agua deriva del latín aqua, que alude al conocido líquido claro e inodoro. Por esta raíz latina que se observen decenas de términos derivados de uso frecuente, como acuario, acuarela, aguada, aguaza, aguajal, aguafuerte, aguamanil, aguarrás y otros, aunque en algunas palabras no tiene conexión, como el caso de «aguacate», palabra que proviene del náhuatl «ahuacatl», que en ese idioma se traduce como «testículos del árbol». El latín antiguo aquam proviene del protoitálico *akwa, que es la raíz indoeuropea correspondiente.
En contraparte, para «agua» se utilizaba, en griego antiguo, el término ‘υδωρ (hidor). Por ello, encontramos esta raíz, castellanizada como «hidro», en muchas palabras compuestas que se refieren al agua, como son los casos de hidrógeno, hidrostática, hidráulico, hidrológico, hidrófobo, hidrocefalia y otras más. Así, el prefijo hidro se utiliza para establecer relación con todo aquello que tiene presencia o relación con el agua. Empero, amerita acotar que también se usa con referencia a todo lo relacionado con el hidrógeno o a los líquidos en general. Esto último es importante, pues, por antonomasia, el uso de la palabra alude, en general, a una substancia líquida.
Lo que sucede es que, al existir en abundancia, y por sus propiedades fisicoquímicas, el agua se mezcla con suma facilidad con una gran cantidad de substancias, o, dicho de otra manera, estas otras substancias suelen disolverse o quedar suspendidas en un medio acuoso. La mezcla, a nivel físico, puede ocurrir en distintos niveles, sin dar lugar a cambios químicos de las substancia o moléculas que componen la disolución, como cuando se combina alcohol (etanol), azúcar o sal con una cantidad de agua. La destilación es el proceso físico que nos permitiría separar los componentes o substancias presentes en una mezcla líquida.
El agua posee muchas propiedades interesantes, pero quizá la más importante es que resulta indispensable para el origen y el sustento de toda forma de vida. Siendo el agua un elemento crítico para la supervivencia de todos los organismos vivos en el planeta, resulta importante conocer el estado y disponibilidad de agua en la Tierra, pues en alguna época pretérita, se suponía un recurso infinito, cuando, en realidad, se trata de un recurso finito y acotado, detalle que hace un par de siglos no fue considerado en disciplinas sociales, como la economía, que no consideró la relevancia de un hecho fundamental: algunos recursos naturales podrían agotarse. En Wikipedia, sobre la importancia del agua para la biota, se lee:
Algunos organismos pueden usar agua salada, pero muchos, incluyendo la gran mayoría de las plantas superiores y la mayoría de los mamíferos deben tener acceso a agua dulce para sobrevivir. Algunos mamíferos terrestres, tales como roedores del desierto, parecen sobrevivir sin beber, pero en realidad generan agua a través del metabolismo de semillas de cereales, y cuentan con mecanismos eficientes para conservar el agua.

Cabe preguntarse cuánta agua «dulce» tenemos en el planeta. Resulta que el 97.25% de la hidrósfera (la totalidad de agua en la Tierra) se encuentra en los océanos. De esta forma, podemos considerar que el 97.4 % del agua es salada, ubicada en los océanos, los mares y las aguas subterráneas saladas. Se denomina agua salada pues la concentración de sales minerales disueltas es alta, de un 3.5 %, lo que significa que, en promedio, de cada 1000 partes de agua, 35 serán sales disueltas. Se denomina agua dulce, cuando la salinidad es baja, con niveles de menos del 0.1 % de concentración de sal. No es que sea dulce, es que tiene muy poca sal.
Ciertamente la salinidad del agua no es constante a nivel planetario, y aunque se trata de variaciones porcentuales muy pequeñas, influyen significativamente en los movimientos que se observan en los océanos. En la imagen última se muestra un mapamundi con colores, indicando la salinidad de los océanos, según la geografía. Existen cuatro rangos en torno de la salinidad del agua, a saber: a) dulce, de 0 % a 1 %; b) salobre, de 1 % a 3 %; c) salada, de 3 % a 5 %; y salmuera, si la concentración de sales es superior al 5 %. Como veremos, a mayor salinidad, ciertas características físicas cambian, siendo una de ellas la densidad.
Según el prescrito porcentaje de agua salada, tenemos que únicamente el 2.6 % del agua del planeta es agua dulce. Sin embargo, simplificando las estimaciones, el 2 % se encuentra congelada en los glaciares, hielo y nieve, mientras el 0.6 % restante se encuentra en aguas subterráneas dulces y en la humedad del suelo. El dato final es que menos de 0,01 % del total de la hidrósfera es agua superficial, la que se encuentra en lagos, pantanos y ríos. De este tan pequeño porcentaje, el 87 % está en los lagos. Imagínese el lector la importancia de no contaminar el agua dulce disponible. De hecho, en la actualidad menos del 30 % del agua superficial no está contaminada, lo que viene a ser menos del 0.003 % de la hidrósfera. Sobre ello, se lee:
El agua dulce es un recurso natural indispensable para la supervivencia de todos los ecosistemas. El uso del agua por los seres humanos para actividades como el riego y usos industriales puede tener efectos adversos en los ecosistemas aguas abajo. La contaminación química del agua dulce también puede dañar gravemente el equilibrio ecosistémico. Una preocupación importante para la ecología hidrológica es asegurar un caudal mínimo, también para la preservación y restauración de asignaciones de agua no consuntivas. La contaminación del ambiente por la actividad humana, incluidos los derrames de petróleo, también presenta un problema para los recursos de agua dulce […] contaminando no solo el agua sino la flora y la fauna también.
Pero regresando al agua en sí, creo que si algo aprendemos en nuestro transitar por la escuela elemental es que una molécula de agua está formada por dos átomos de hidrógeno (H) y una de oxígeno (O), formando la consabida molécula H2O. Al comprender este hecho fisicoquímico aprendemos también una buena parte de la teoría atómica y química de todas las substancias físicas, que, al igual que el agua, están constituidas por moléculas y estas por átomos, que, enlazados químicamente, es decir, mediante enlaces de tipo eléctrico, forman las primeras.
La definición del agua se realiza, entonces, presentando su composición química, a nivel molecular: una sustancia cuya molécula está compuesta por dos átomos de hidrógeno y uno de oxígeno (H2O) unidos por un enlace covalente. Sin embargo. las substancias, en general, pueden mezclarse físicamente, sin llegar a recomponerse químicamente, compartiendo el mismo espacio, pero conservando su autonomía química.
El agua es una de las substancias que encontraremos siempre con otros componentes, sea diluidos, sea en suspensión. Sin embargo, los componentes disueltos no deben representar una proporción tan elevada como la que hemos mencionado de las sales, que en el agua de mar supera el 3 %, pero, por lo general no supera el 3.6 %. Por otro lado, el agua totalmente «pura» no existe en la naturaleza. Debería realizarse un complejo proceso para lograr una «purificación tal».
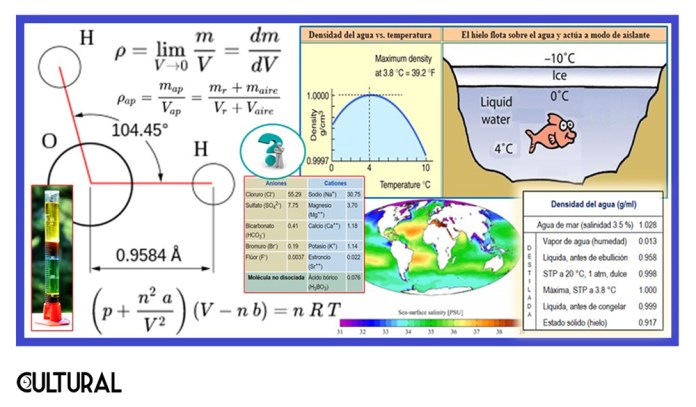
Con relación a esto último, resulta que hasta dos terceras partes de los elementos químicos se encuentran presentes en el agua de mar, léase, más de 60 elementos de la tabla periódica están allí, aunque, claro, vale señalar, en muy pequeñas cantidades, denominadas trazas. Nuevamente, en la imagen última aparece un cuadro con los principales solutos en el agua de mar. Del 3.5 % de sales promedio, el 86 % los componentes de la sal común (NaCl), el 11 % los componentes del sulfato de magnesio (sal inglesa: MgSO4·7H2O) y otros más en menor proporción.
Pensando en el hecho de que cualquier agua contendrá otros posibles elementos, es decir, conceptualizándola como una mezcla, una disolución, deseamos en esta oportunidad conversar sobre una propiedad en la que no solemos reparar: la densidad. En efecto en artículos previos hemos compartido que en toda mezcla se realizan operaciones con las variables que describen los componentes. En suma, las variables extensivas se suman, mientras que las variables intensivas se promedian. Así, al mezclar dos partes líquidas, tendremos que el volumen y la masa de las partes se suman, mientras la temperatura y la densidad se promedian, por citar un par de casos en cada situación.

Ilustremos estas nociones y la distinción del tipo de magnitudes mediante un ejemplo concreto, sobre el comportamiento de las variables al realizar una mezcla. Supóngase que se procede a mezclar dos líquidos: 30 ml de agua a 10° C con 20 ml de vino a temperatura ambiente, 20° C. Entonces, la mezcla, respecto al volumen tendrá 50 ml, que es la suma de los volúmenes en las partes. El volumen es una magnitud extensiva. Sin embargo, la temperatura no ha de sumarse, sino promediarse, que resultará en 14° C. Nótese que este promedio está ponderado por las cantidades: 14° = (10° (30) + 20° (20) ) / (30 + 20) = 700° / 50. De haberse tratado de cantidades iguales, el promedio de 10° y 20° hubiera sido el usual promedio simple: 15°.
De similar forma, la masa, el peso de la mezcla, será obtenido por suma. Sin embargo, nuevamente, el grado alcohólico de este vino aguado, mezclado con agua, deberá ser calculado mediante un promedio, pues se trata de una magnitud intensiva. Dado que el agua tiene 0° GL y suponiendo que el vino posee 12.5° GL, tenemos entonces que le promedio pesado será: (0° GL (30) + 12.5° (20) ) / (30 + 20) = 250° GL / 50 = 5° GL. Si en vez de agua usamos jugo y otros componentes líquidos no alcohólicos, tendríamos, al mezclar, una sangría al 5 % de alcohol. Obsérvese que el contenido porcentual alcohólico se obtiene de la razón de alcohol (etanol) puro al total del líquido que lo contine, es decir, es el cociente de dos magnitudes extensivas, los volúmenes.
Pues bien, la citación viene al caso que la densidad de una cierta substancia es también una magnitud intensiva, pues proviene de la razón de dos extensiones: la masa y el volumen. En física y química, la densidad (del latín, densĭtas, -ātis) es una magnitud escalar referida a la cantidad de masa en un determinado volumen de una sustancia o un objeto sólido. Por ello se calcula dividiendo la masa de la que se trata entre el volumen que esta masa ocupa. Esto da el valor promedio de la densidad.
Al tratarse de una magnitud de tipo intensivo, su naturaleza es local y su definición más rigurosa requiere de la herramienta infinitesimal, esto es, referida a porciones muy pequeñas del todo macroscópico. Usualmente, se simboliza mediante la letra ro (ρ) del alfabeto griego, pero también se usa la letra delta (δ), que hemos utilizado en la imagen previa. Así: δ = dm/dV (aquí la letra «d» denota un diferencial).
En cualquier mezcla, las densidades medias del total obtenido resultarán del promedio ponderado de las densidades medias de las partes que se están combinando. Esto sucede al considerar sólidos, áridos, líquidos, gases o cualquier otro tipo de substancia. Por ejemplo, sucede en un objeto grande, como un barco. En el artículo «Por qué flota un barco», en dos partes, explicábamos que, aunque el hierro y la mayoría de contenidos en un buque son más densos que el agua, más pesados, al promediar todo el contenido, inclusive el aire en los huecos que tiene, se obtiene una densidad menor que el agua, razón por la cual el buque en su totalidad flota… porque es menos denso que el agua.
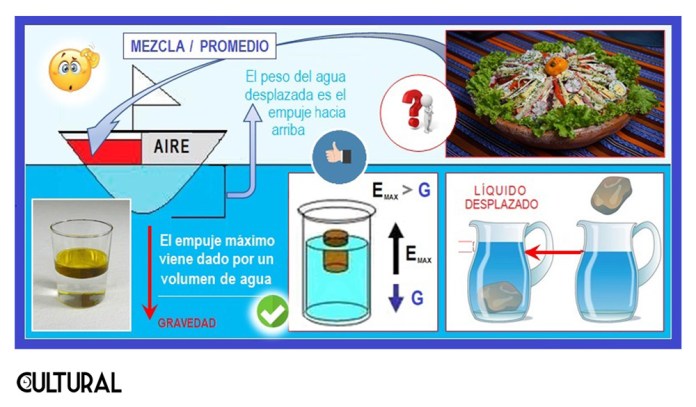
Este principio de que las cosas más pesadas, es decir, más densas, se van para abajo, es fundamental. Los gases densos están debajo de los menos densos. En la imagen previa se ve que el aceite se coloca por encima del agua, o del vinagre, pues el aceite es menos denso que el agua y el vinagre. De hecho, una forma de saber qué substancia, o cuerpo, es más o menos denso es observar cuál se coloca más arriba, siempre que esto sea posible. Una piedra ordinaria se hunde en el agua, pero una piedra pómez flota. En un aliño, al agitarlo, la substancia parece homogenizarse, pero al rato veremos cómo el aceite, que no se disuelve en el vinagre, se moviliza hacia para arriba.
En el artículo «Prolegómenos a los promedios: aritmético y geométrico» compartíamos la célebre anécdota de Arquímedes de Siracusa con relación a la corona
De acuerdo con el relato de Vitruvio, Hierón II ordenó la fabricación de una nueva corona de oro, con forma de corona triunfal, y le pidió a Arquímedes que determinará si la corona estaba hecha solo de oro o si, por el contrario, un orfebre deshonesto le había agregado pirita en su realización. Arquímedes tenía que resolver el problema sin dañar la corona, así que no podía fundirla y convertirla en un cuerpo regular para calcular su masa y volumen, a partir de ahí, su densidad.
A Arquímedes se le reconoce como físico, matemático y filósofo, pero también como gran ingeniero e inventor, siendo precursor de la hidrostática y del cálculo infinitesimal. En la imagen anterior se ilustra uno de sus principios epónimos. Célebre es la anécdota en la que el sabio salió desnudo de la bañera gritando «¡Eureka, eureka!», al haber comprendido que el empuje de ascenso sobre un cuerpo sumergido equivalía al peso del líquido desplazado. No se sabe el resultado del caso de la corona del rey Hieron II, en el sentido de si el orfebre en cuestión resultó ser un tramposo o un tipo recto, pero lo que sí trascendió fue el cúmulo de aplicaciones que desde la experiencia pudieron originarse.
Por ejemplo, un globo flota gracias al uso de un gas menos denso que el aire medio. Una forma de lograr este gas más liviano es calentando el mismo aire, puesto que al aumentar la temperatura, las moléculas se muevne más rápido, lo que lleva a que choquen entre sí más seguido obteniendo un volumen mayor. Así, la misma cantidad de aire, la misma masa, al ocupar un mayor espacio, tendrá menos densidad. Un aire caliente es menos denso que un aire más templado. De hecho, casi cualquier substancia al calentarse se expandirá, por lo que será menos densa conforme más caliente está. Una particular substancia tiene un comportamiento diferente: el agua.
Como todas y todos hemos podido constatar, al soltar un hielo en agua (líquida), vemos que este no se hunde, flota. Esto nos dice que el hielo es menos denso que el agua, cosa que es una anomalía, porque casi todas las substancias, en estado sólido, es decir, a más baja temperatura, se vuelven más densas, más pesadas, al ocupar menos espacio al compactificarme más para sostener el estado sólido. Pero con el hielo, el agua en estado sólido, pasa a la inversa.
Otra forma de evidenciar el fenómeno, es darnos cuenta de le hecho que una cantidad de agua, al congelarse, se hincha, se expande, lo que nos hace guardar cuidados, porque pueden romperse los contenedores que guardan agua, como es el caso de las tuberías. Es a la inversa de como sucede con los rieles de tren o con cualquier metal. Al calentarse se hace más grande. Si dejamos muy justo ciertas barras de metal, al expandirse, podrían causar daños a la estructura. Con el agua es al revés, es al enfriarse, cercano a su punto de fusión, cuando se convierte en hielo, que la densidad disminuye al bajar la temperatura. Para precisar, véase la gráfica en la imagen siguiente.
En este momento, al hablar de la densidad del agua conforme la temperatura a la que se encuentra, estamos imaginando agua «pura», es decir, una colección de moléculas de H2O. No obstante, hemos comentado que tal compuesto no se encuentra en la naturales, y lograrlo de forma artificial, al 100 % de pueraza es también imposible, porque el agua, por su naturaleza fisicopquímica, siempre albergará algún tipo de soluto, sea inorgánico u orgánico, por la misma característica de convertirse en el medio idóneo, ideal, para albergar vida. De esta forma, de una manera rigurosa, la densidad del agua, en estado líquido, dependerá de todos los componentes que contiene, siendo un promedio pesado de las densidades medias de todos ellos.
Sin embargo, las trazas, expresadas en partes por millon (ppm), no podrían variar fuertemente el valor de la densidad media del líquido. Se tendría que tener una proporción mínima, expresable en un determinado porcentaje. Por ejemplo, a simple vista, no podría saberse si un líquido de apariencia acuosa tiene un cierto porcentaje de alcohol o de otra substancia transparente. Si se llega a un 10 % de este otro líuido, la densidad de la mezcla cambiará, para más o para menos según sea el caso.
La situación más común de un soluto sólido es el agua de mar, que hemos dicho contiene un porcentaje medio de 3.5 % de sal. Como el sal es más densa, pesada, que el agua, tendremos que el agua de mar, o el agua salada será más densa que el agua dulce. Veamos ahora en cuánto consiste esta variación. La densidad del agua, inicialmente se fijó en 1 kg/dm3, que equivale a 1 g/cm3.
Este proceso se realizó por definición. Habiendo establecido el valor de 1 m, como la diez millonésima parde de la distancia de la línea del ecuador hacia el polo norte (que se estableción en 10,000 km), se procedió a definir 1 dm3 como un litro. Es decir, si llenamos un cubo de 1 dm x 1 dm x 1 dm, obtendremos el volumen con capacidad de un litro. Finalmente, se pesó un litro de agua y se estableció que esta masa correspondía a 1 kg. Así, la masa de un litro de agua es 1 kg. Como un litro = 1 dm3 contiene 1000 ml = 1000 cm3, se tiene que, al tomar milesimas partes, 1000 ml = 1000 cm3 de agua tienen masa de 1000 g, de donde 1 ml = 1 cm3 de agua tiene masa de 1g.
Por la anterior secuencia, se tiene que, la densidad del agua, originalmente, se estableció en δ = 1 g/ml = 1 g/cm3. Nótese que esta densidad también puede expresarse en equivalencia numérica así: δ = 1 kg/dm3 = 1 kg/l o bien, como sería en el sistema internacional –SI–, δ = 1 kg/dm3. Estas unidades proporcionan, ademas de la conveniencia numérica, una excelente forma para realizar comparaciones con las densidades con otros cuerpos y substancias. Se utiliza mucho la densidad o peso específico, que es, cabalmente, el número abstracto que da la razón entre la densidad en cuestión y la densidad del agua: δ esp = δ / δ agua. Así, un cuerpo flotará (en el agua) si tiene una densidad δ esp < 1
Regresando al agua y su salinidad, resulta que la densidad de la típica agua del mar, entiéndase agua salada con un 3,5 % de sales disueltas, suele ser de 1.02819 kg/l a los −2 °C, 1.02811 a los 0 °C, 1.02778 a los 4 °C. Este valor es superior a la densidad de agua dulce. Al margen de otros factores de composición se tiene que el para el agua dulce promedio δ = 0.998 g/cm3 a CTP (condiciones normales de temperatura y presión), es decir a 20º C y a una presión de 1 atmósfera, con salinidad nula, de agua destilada. Al considerar la densidad media de toda la hidrósfera, veremos que es mayor a 1, puesto que, como hemos dicho, el 97.4 % del agua de la Tierra es salada, por lo que al obtener un promedio ponderado obtendríamos δ > 1.
Un detale es que el empuje, la fuerza que nos empuja hacia arriba al sumergirnos en un líquido es mayor conforme el líguido es más denso. Flotamos en el agua dulce porque nuestra densidad media es menor que la densidad del agua, lo que es posible por las bolsas de aire que representan los pulmones. Al promediar la densidad de este poco aire con el resto del cuerpo, de carne, huesos y substancias, se obtiene δ persona < 1. Sin embargo, flotamos más fácil en agua salada, un pocquito más fácil, porque el agua salada es más densa, lo que hace que el empuje que ejerce el líquido salado es mayor.
A manera de conclusión, estamos claros que lo usual es que los cuerpos y substancia, al calentarse, se vuelvan menos densos, lo que hace que se vayan hacia arriba. Los gases más pesados se quedan abajo, los livianos ascienden. Por eso en un incendio, lo gases calientes y tóxicos suben, por lo que será mejor respirar los aires bajos. Igual sucede con el agua y los líquidos. Los fluidos calientes tenderán a subir. Pero también hemos visto que lo que está detrás de este posicionamiento es la densidad. Los cuerpos y substancias menos densos se ubicarán más arriba. Si echas una parte de alcohol en un mezclador, y no lo bates, la parte alcoholica se quedará arriba, porque el etanol es menos denso de el agua: δ alcohol ≃ 0.8 < 1
Aunque se trate de pequeñas diferencias, en densidad o temperatura, en grandes masas se generarán fuertes desplazamientos. Las variaciones de temperatura en los gases atmosféricos producen fuertes corrientes de vientos, al igual que variaciones en la presión, porque ambas magnitudes influyen en la densidad del aire. Igual sucede con los oceanos. El tiro es que las diferencias de salinidad entre masas de agua se combinan con las de temperatura para producir diferencias de densidad, que a su vez son responsables de la convección en que se basa la circulación oceánica a gran escala, la llamada por ello circulación termohalina. Sobre esta se lee:
En oceanografía física se denomina circulación termohalina (CTH) o, metafóricamente, cinta transportadora oceánica, a una parte de la circulación oceánica a gran escala que es determinada por los gradientes de densidad globales producto del calor en la superficie y los flujos de agua dulce. Es muy importante por su significativa participación en el flujo neto de calor desde las regiones tropicales hacia las polares, y su influencia sobre el clima terrestre.
Por otro lado, hemos compartido que la anómala variación de la densidad con la temperatura, entre los 3.8º C (cuando adquiere su densidad máxima) y los 0° C tiene por resultado que el hielo flote en el agua líquida. Esto tiene, en los océanos, un efecto importante, pues el hielo actúa como aislante térmico, posibilitando, como consecuencia, el mantenimiento de la gran masa de agua de los océanos, en fase líquida, a 4º C. Como hemos planteado, los océannos representan la mayor parte de la hidrósfera, pero, por otro lado, de la biosfera, albergando la biopta primigenia y la basal, de la que dependen el resto de los ecosistemas del planeta. En otras palabras, si el hielo no flotara, sino se hundiera, el agua de la Tierra estaría toda congelada.
Finalizo este pequeño mar de datos, notas y curiosidades, con una reflexión ecológica sobre el agua dulce superficial. Resulta que en las zonas sin agua de este tipo, el agua dulce derivada de las precipitaciones puede, debido a su menor densidad, superponerse a las aguas subterráneas salinas en lentes o capas, lo que le representa mayor mobilidad y riesgo de contaminación antropogénica. Se trata de un recurso natural renovable y variable, pero también limitado. El agua dulce solo puede reponerse a través del ciclo natural del agua, un proceso en el cual el agua de los mares, lagos, bosques, tierras, ríos y embalses se evapora, forma nubes y vuelve a través de la precipitación. Este ciclo tiene su ritmo y peridicidad propios.
El problema es que, si a nivel local las actividades humanas consumen más agua dulce, esto puede redundar en una menor disponibilidad a partir de fuentes superficiales y subterráneas, con la posibilidad de causar graves daños al entorno y los ambientes asociados. Si tenemos en cuenta que la población mundial sigue creciendo, tratándose de un recurso limitado, las proyecciones plantean fácilmente futura escasez, plausible motivo para próximos conflictos internacionales o globales. Muchas reflexiones nos vienen a la cabeza cuando pensamos la temática de la disponibilidad de agua no contaminada, la cual pareciera estar disminuyendo. Al respecto leemos:
Existen diferentes causas para la aparente disminución del agua potable disponible. Las principales razones incluyen el crecimiento de la población por el aumento de la esperanza de vida, el incremento del uso de agua per cápita. También es probable que el cambio climático resulte en un cambio en la disponibilidad y distribución del agua dulce en todo el planeta. Si el calentamiento global continúa derritiendo glaciares en las regiones polares, tal como se pronostica, la disponibilidad de agua dulce puede disminuir. En primer lugar, el agua dulce de los glaciares se mezclará con el agua salada de los océanos y se volverá demasiado salada para beber. En segundo lugar, el aumento del volumen de los océanos hará que los niveles del mar se eleven, contaminando con agua de mar las fuentes de agua dulce a lo largo de las regiones costeras.
Fuente de imágenes ::
[ 1 + 4 ] Imágenes editada por Vinicio Barrientos Carles :: https://es.wikipedia.org/wiki/Agua_de_mar + https://www.iagua.es/respuestas/cual-es-densidad-agua + https://es.wikipedia.org/wiki/Densidad + https://es.wikipedia.org/wiki/Agua
[ 2 ] Imagen tomada de gAZeta, editada por vbc :: https://www.gazeta.gt/prolegomenos-a-los-promedios-aritmetico-y-geometrico-iii/
[ 3 ] Imagen tomada de gAZeta, editada por vbc :: https://www.gazeta.gt/por-que-flota-un-barco-ii/








